Скачать ГОСТ Р 57680-2017 Производство лекарственных средств. Руководство по использованию компьютеризованных систем в системах качества GxPДата актуализации: 01.01.2018
|
| Обозначение: |  ГОСТ Р 57680-2017 ГОСТ Р 57680-2017 |
| Обозначение англ: |  GOST R 57680-2017 GOST R 57680-2017 |
| Статус: | принят |
| Название рус.: | Производство лекарственных средств. Руководство по использованию компьютеризованных систем в системах качества GxP |
| Название англ.: | Manufacturing of medicinal product. Guidance for using computerized systems in quality systems regulated GxP |
| Дата добавления в базу: | 01.01.2018 |
| Дата актуализации: | 01.01.2018 |
| Дата введения: | 19.09.2017 |
| Дата окончания срока действия: | 01.08.2018 |
| Область применения: | Область применения стандарта распространяется на использование КС в организациях, осуществляющих работы в сфере обращения лекарственных средств в соответствии с правилами надлежащей производственной практики, надлежащей дистрибьюторской практики. Также он может применяться организациями, работающими в соответствии с надлежащей лабораторной практикой. Организации сами определяют пригодное для них программное приложение, подразделения, в которых оно внедряется, и соответствующие результаты его работы. В стандарте описаны подходы и виды контроля (параметры), которые могут быть использованы для обеспечения соответствия данных работ требованиям надлежащих практик. Также стандарт описывает основные этапы и документацию в отношении внедрения и валидации КС в организации, включая различные подходы к разным типам систем и различные виды валидации. Учитывая итеративный характер КС, в стандарте также представлены рекомендации для поставщиков и разработчиков приложений и автоматизированных систем, поставляемых в организации, работающие в условиях надлежащих практик. |
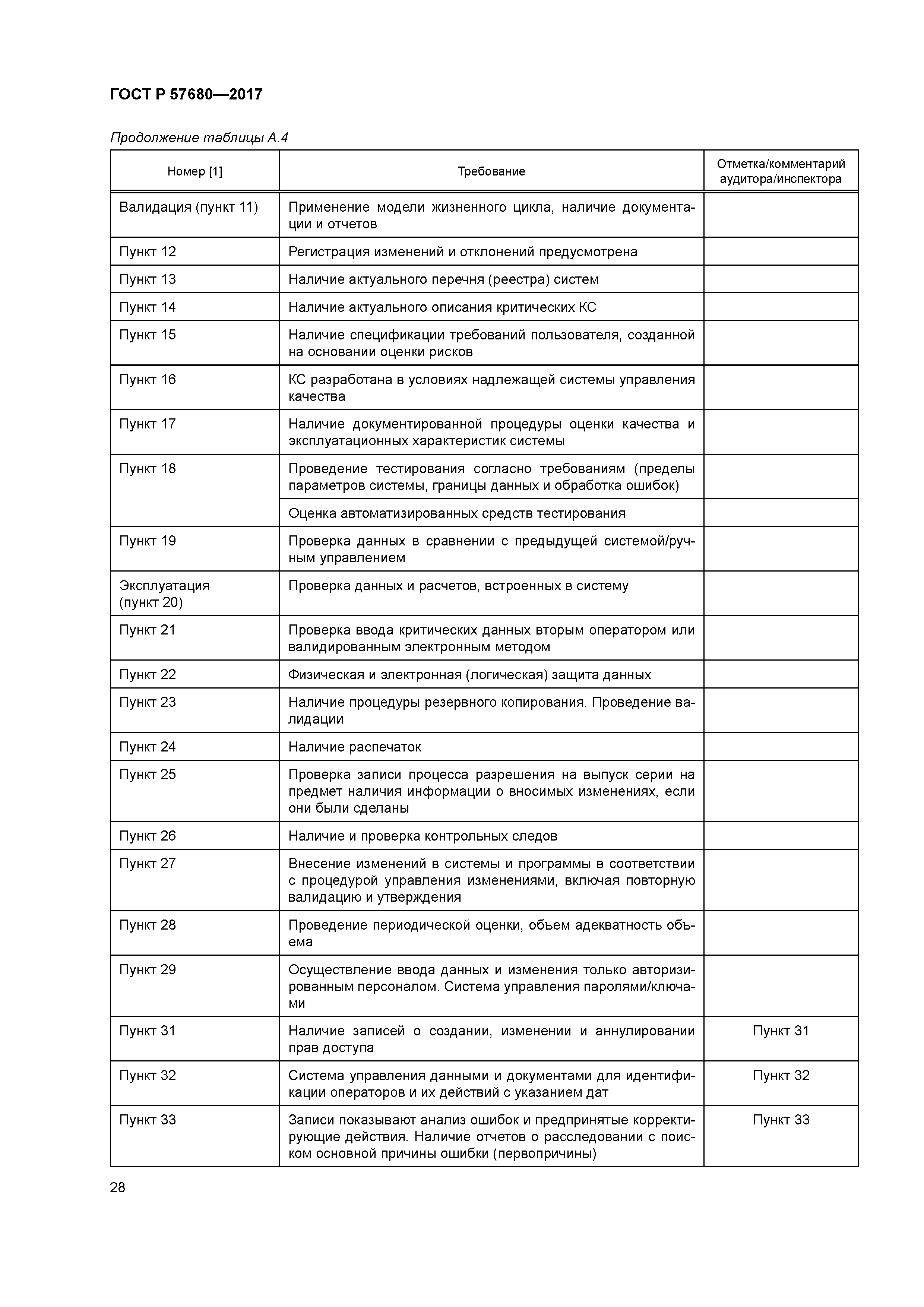
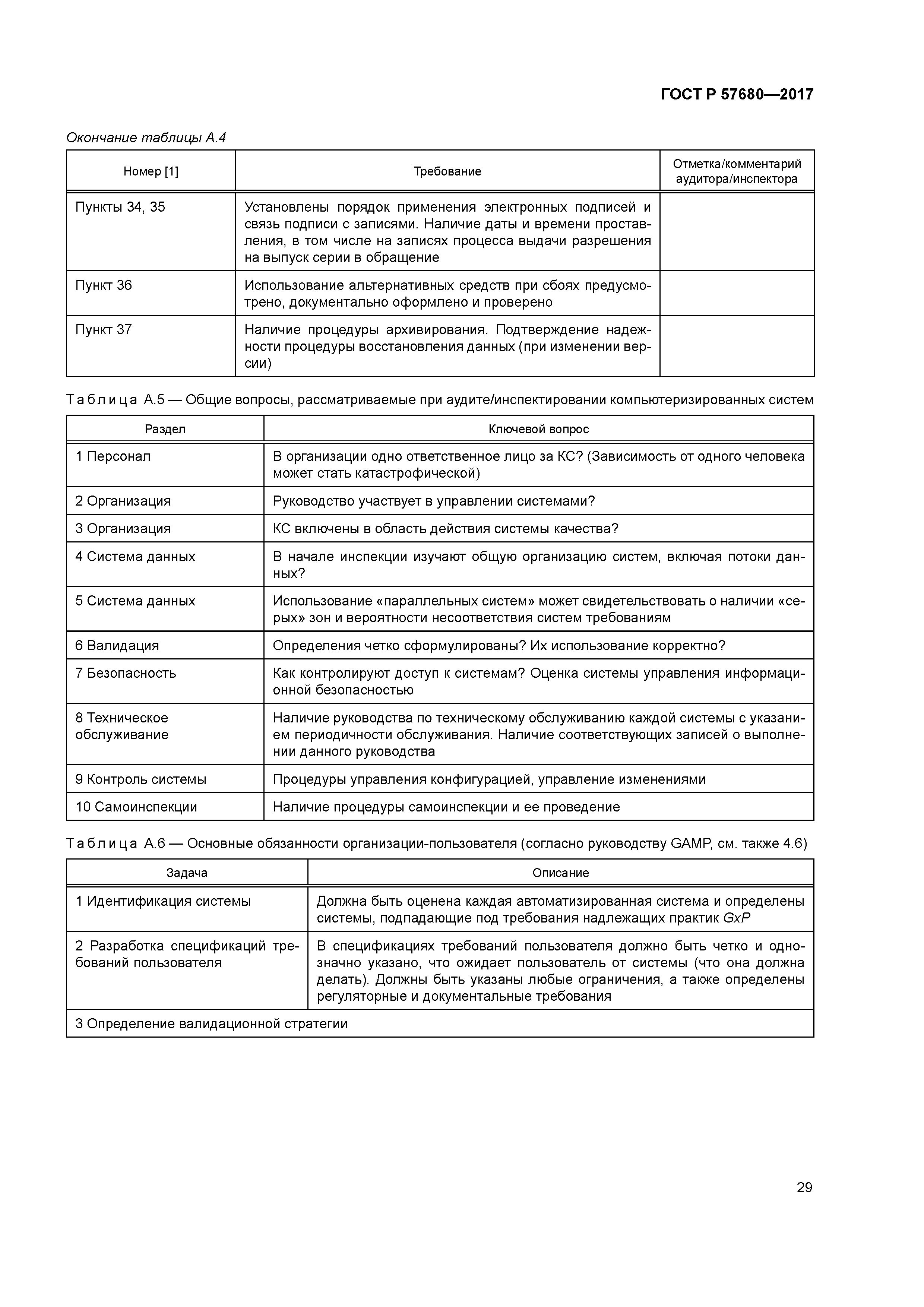
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Общие положения 4.1 Структура и функции компьютеризованных систем 4.2 Управление рисками 4.3 Персонал 4.4 Поставщики и провайдеры услуг 4.5 Документация 5 Стадия проекта 5.1 Менеджмент качества 5.2 Планирование и управление жизненным циклом 5.3 Спецификации требований пользователя 5.4 Функциональная спецификация FS 5.5 Тестирование 5.6 Валидация 6 Стадия эксплуатации 6.1 Данные 6.2 Контроль правильности ввода данных 6.3 Хранение данных 6.4 Распечатки 6.5 Контрольные следы (autotrail) 6.6 Управление изменениями и конфигурацией 6.7 Периодическая оценка 6.8 Защита 6.9 Управление инцидентами 6.10 Электронная подпись 6.11 Выпуск серии 6.12 Непрерывность работы 6.13 Архивирование Приложение А (справочное) Рекомендации по аудиту/инспектированию использования компьютеризированных систем в организации Библиография |
| Разработан: | Первый Московский государственный медицинский университет им. И.М. Сеченова |
| Утверждён: | 19.09.2017 Федеральное агентство по техническому регулированию и метрологии (1166-ст) |
| Издан: | Стандартинформ (2017 г. ) |
| Нормативные ссылки: |
|




































 ГОСТ Р ИСО 10007-2007 «Менеджмент организации. Руководящие указания по управлению конфигурацией»
ГОСТ Р ИСО 10007-2007 «Менеджмент организации. Руководящие указания по управлению конфигурацией»